-
화학반응공학 실험 보고서_전기변색소자(electrochromic) 결과 보고서_Ver2_200516_R0화학공학실험 족보 2020. 5. 16. 14:23
1. 실험 방법
1) 전해질 용액 제조
① 전자저울을 이용하여 텅스텐 분말 0.92g을 계량하고 매스실린더를 이용해 과산화수소 를 과량인 10ml를 계량하여 혼합한다. 텅스텐을 모두 반응시키기 위해 과량의 과산화수소를 넣는다. 용액을 가열시키는 과정이 있는데 이때 과산화수소가 증발되는 것을 막기 위해 소량의 증류수를 넣어준다.
② 마그네틱바를 이용하여 교반시키고 가열하면서 반응을 시켜서 모든 텅스텐 분말이 과산화수소에 용해되도록 한다. 용액이 점점 투명해지고 오랜 시간 동안 교반시키면 부반응이 일어나 흰색 물질이 생성될 수 있으므로 주의한다. (약 20분 소요)
③ 반응이 모두 진행되면 증류수를 이용하여 용액을 50ml로 제조한다. 산화텅스텐의 몰질량은 183.85g/mol 이므로 0.92g은 0.005mol이다. 0.1M의 용액을 만들기 위해서는 전체용액의 부피가 50ml 이어야 한다.
④ 교반이 완전히 진행 된 용액을 AO disk를 이용하여 생성물 중에 남아있는 과량의 과산화수소를 제거한다. (AO disk는 Aluminium Oxide로 구성되어 있으며 촉매작용을 한다.)

2) 기판 준비
⑤ ITO glass(1*3) 4개를 준비하여 iso-propanol과 아세톤으로 세척한다. 초음파 세척기를 이용하여 먼지 및 유기물을 완전히 제거한다.(30분 소요)
⑥ 세척이 완료되면 마지막으로 증류수로 세척한 후 물기를 제거한다.
⑦ 멀티미터를 이용해 소리가 나는 면을 찾아 ITO 유리판에서 전도성이 있는 면을 확인한다. 확인 후, 네임펜을 이용하여 표시를 한다.

3) 전극제조
⑧ 3전극 시스템을 구성한다. WE(Working Electrode)에는 ITO 유리판, CE(Counter Electrode)에는 Pt, RE(Reference Electrode)에는 AgCl을 사용한 3전극 전기화학 시스템을 구성한다. ITO유리판은 전기가 통하는 면이 RE를 바라보게 설치한다. 구성된 3전극 시스템을 앞서 만든 용액에 담근다. 이때 집게가 용액에 닿지 않도록 주의한다.
⑨ LSV(선형 주사 전압-전류법)를 이용하여 1V→-1V 까지 변화시키면서 관찰한다.
⑩ 3개의 전압을 선정하여 각각의 ITO glass에 해당되는 전압에서 CA(일정전압법)을 이용하여 산화텅스텐을 증착시킨다.
⑪ 0.5M의 황산용액에 전극을 담그고 CV(순환 전압-전류법)를 이용하여 전압에 따른 전류의 변화 그래프와 수소이온의 인터칼레이션/디인터칼레이션에 따른 ITO 유리판의 색변화를 관찰한다.
⑫ 실험에 사용된 장비들을 정리하고, 폐용액은 분리하여 버린다.
2. 결과 및 고찰
① Tungsten과 H2O2몰 비율 계산
(H2O2의 비중=1.11 30%의 H2O2를 사용하였음)
- 먼저 텅스텐의 몰수를 구하면 텅스텐의 몰 질량은 183.85g/mol이고 실험에서 0.92g을 사용하였으므로 다음과 같다.

H2O2의 비중이 1.11 이고 실험에서 사용한 10ml의 질량 비중과 부피를 통해 질량을 알 수 있으므로 그 값은 다음과 같다.

또한 30%의 H2O2라고 하였으므로 순수한 H2O2의 질량은 이다. H2O2의 몰 질량은 34.01g/mol 이므로 몰수는 다음과 같다.

따라서 텅스텐과 H2O2의 몰비율은 임을 알 수 있다.
2. AO Disk
- AO disk 촉매를 텅스텐+과산화수소 용액에 넣으면 과산화수소가 물과 산소로 분해 하여 산소기체가 발생한다. 백금, 은 등 AO-disk와 같은 금속 촉매를 과산화수소와 반응시키면 산화-환원 반응으로 과산화수소가 분해하여 산소가 발생하게 된다.(발열반응)

이번 실험에서 AO disk를 사용하는 이유는 산화텅스텐 용액을 만드는 과정에서 반응하지 않고 남은 과산화수소를 없애기 위해서 사용한다. 과산화수소가 남아있게 되면 후에 우리가 원하지 않은 부반응이 일어날 수 있다.



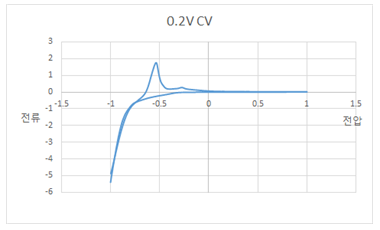

4. 색변화
- 산화 텅스텐은 결정구조를 가지며 빈 공간은 게스트 이온이 삽입될 만한 공간을 제공한다. 이번 실험에서는 황산에서의 수소이온이 이 공간을 들어갔다,나왔다를 반복하며 인터칼레이션과 디인터칼레이션이 일어난다. 또한 환원상태에서 푸른색이 나타나고 산화상태에서 색이 없어지는 환원발색의 대표적인 물질이다. 이러한 물질을 전기변색소자라고 한다. 이러한 산화 텅스텐이 전해질로 황산용액을 사용했을 때 전기변색 성질을 나타내는 메카니즘을 살펴보면 다음과 같다.

오른쪽으로 반응이 진행되면 인터칼레이션(환원)이 일어나면서 색이 청색으로 변하고 왼쪽으로 반응이 진행되면 디인터칼레이션(산화)이 일어나면서 다시 투명해진다. 이러한 색 변화 정도는 전압의 세기를 조절함으로써 제어할 수 있다. 실험 결과 색이 가장 진하게 관찰되었던 경우는 -0.9V였고 -0.7V, -0.5V 순으로 색이 점점 옅어졌다.
이러한 결과가 나타난 이유는 다음과 같다. 먼저 아래 그래프는 위에서 진행한 각각 다른 전압에서의 CV그래프를 한 번에 나타낸 것이다.

이 그래프를 살펴보면 전압이 높을수록 최고점 전류값이 높게 측정됨을 알 수 있다. 전류라는 것이 전자가 많이 이동하면 그 값이 크게 나타난다.

전류값이 높다는 것은 가역반응에 참여하는 이온의 수, 즉 이번 실험에서는 인터칼레이션/디인터칼레이션되는 수소이온의 수가 많다는 뜻이다. 따라서 전압이 높을수록 산화환원반응에 참여하는 수소이온이 증가하기 때문에 색변화가 뚜렷하고 진하게 나타난다. 이렇게 전압의 세기를 조절함에 따라 변색정도가 다른 것을 이용하여 전기변색소자는 전자종이, 디스플레이 등에 이용되고 있다.
3. Problems
① 텅스텐(W) 이외의 전기변색소자 물질 조사.
① 그 외의 전기변색소자 물질 조사.
- 전기변색 소자 재료에는 세 가지 종류가 있다. 전도성이 있는 고분자, 무기물로 구성되어있는 metal oxide 그리고 유기물로 구성되어진 molecular dye가 있다. 먼저 전기변색 전도성 고분자는 무기 물질과 달리 높은 변색 효율, 빠른 응답속도, 높은 안정성, 같은 물질내의 다양한 색변화를 만들어낼 수 있는 장점이 있다. 그 종류로는 폴리아닐린(polyaniline), 폴리피롤(polypyrrole), 폴리티오펜(polythiophene) 등이 있다.
metal oxide의 경우 반응시간이 molecular dye와 비교해볼 때 느리며 그 범위는 15~60 초이다. 그에 반해 molecular dye는 매우 빠르게 반응 할 수 있어 디스플레이의 응용에 연구되고 있다. metal oxide에는 코발트(Co), 인듐(In), 이리듐(Ir), 몰리브덴(Mo), 니켈(Ni), 텅스텐(W), 바나듐(V), 세륨(Ce), 망간(Mn), 니오브(Nb), 로듐(Rh), 루테늄(Ru) 등이 있다.
환원상태에서 색이 나타나고 산화상태에서 색이 없어지는 것을 환원 발색이라고 하고 그 반대의 경우를 산화 발색이라고 한다. 환원 발색의 대표적인 물질에 , , 등이 있고 산화 발색에는 , 등이 대표적이다. 그 외의 대표적인 변색재료는 아래의 표와 같다.

② 텅스텐(W)이 과산화수소(H2O2)와 반응하는 화학반응식과 반응 후 만들어진 생성물이 산화텅스텐(WO3)로 증착되는 화학반응식을 쓰시오.
② 텅스텐(W)이 과산화수소(H2O2)와 반응하는 화학반응식과 반응 후 만들어진 생성물이 산화텅스텐(WO3)로 증착되는 화학반응식을 쓰시오.
- 텅스텐은 과산화수소와 반응하여 peroxytungstate와 수소이온이 나오게 된다. 이를 계수에 맞게 반응식을 나타내면 다음과 같다.

peroxytungstate와 수소이온은 다시 반응 하여 산화텅스텐과 산소, 물을 생성하게 된다.

이처럼 텅스텐과 과산화수소가 반응하면 경국 산화텅스텐과 산소, 물이 생성되게 된다.
③ 1.5M의 황산용액 300ml를 부피플라스크를 사용하여 제조하는 방법을 자세하게 서술하시오. (계산방법, 추가적인 실험도구 등 모르는 부분들은 가정해서 사용해도 됨.)
③ 0.5 M의 황산용액 250ml를 제조하는 방법을 자세하게 서술하시오. (계산방법, 실험도구 등. 모르는 부분들은 가정해서 사용해도 됨.)
- 0.5M 란 1L 용액에 용질이 0.5mol 녹아있는 상태를 뜻한다. 따라서 0.5M농도 황산용액 250ml를 만들기 위해서는 0.5mol의 황산과 증류수를 섞어 250ml의 용액을 만들어야 한다. 먼저 98% 황산과 부피를 측정할 수 있는 플라스크, 비커, 전자저울을 준비한다. 황산의 몰질량은 98.08g/mol이므로 0.5mol의 황산의 질량은 다음과 같다.

그런데 98% 황산을 사용하므로

을 사용해야 한다. 이 때 50.04g의 황산을 플라스크에 넣고 물을 넣어 250ml의 용액을 만들면 된다. 이때 필요한 황산을 부피로 환산해보자. 황산의 비중을 약 1.80g/mL이므로 50.04g의 황산은

이다. 황산이 매우 강한 산이고 물과 반응시에 반응이 격렬하게 일어나며 발열반응이므로 물의 양보다 황산의 양이 많게 되면 폭발의 위험이 있다. 따라서 약 200ml의 물을 먼저 비커에 넣은 후 황산 27.8ml을 피펫을 이용하여 천천히 희석시켜준다. 그 후 용액을 250ml가 되도록 물을 정확이 넣어주면 된다. 이와 같은 방법을 이용하면 0.5M의 황산용액 250ml를 제조할 수 있다.
'화학공학실험 족보' 카테고리의 다른 글
화학반응공학 실험 보고서_유기합성 결과 보고서_Ver2_200516_R0 (0) 2020.05.16 화학반응공학 실험 보고서_유기합성 예비 보고서_Ver2_200516_R0 (0) 2020.05.16 화학반응공학 실험 보고서_전기변색소자(electrochromic) 예비 보고서_Ver2_200516_R0 (0) 2020.05.16 화학반응공학 실험 보고서_Al-air battery 결과 보고서_Ver2_200516_R0 (0) 2020.05.16 화학반응공학 실험 보고서_Al-air battery 예비 보고서_Ver2_200516_R0 (0) 2020.05.16