-
화학 1 “2017년 1학기 중간 시험”화학1 족보 2020. 4. 19. 19:31
화학1 “2017년 1학기 중간 시험”
<5지 선다형 : 각 문항 5점>
1. 다음 설명 중 타당하지 않은 것은?
① 정밀한 측정 장치를 사용하면 우연오차를 줄일 수 있다.
② 온도, 압력 밀도는 모두 세기 성질이다.
③ 흑연, 다이아몬드, C60는 화합물이 아니다.
④ 측정 값의 유효 숫자는 측정한 사람에 따라 달라진다.
⑤ 측정 장치를 보정하면 계통오차를 줄일 수 있다.
답 : 4
2. 기체 분자 운동론에 근거하여 분자의 운동에 대한 다음 설명 중 옳지 않은 것은?
① 온도가 낮을수록 속력 분포의 폭이 좁다.
② 일정 온도에서 분자량이 작을수록 속력 분포의 폭이 넓다.
③ 같은 온도에서 수소 분자들의 평균 속력은 질소의 평균 속력보다 빠르다.
④ 온도가 같으면 기체의 종류와 무관하게 분자가 용기의 벽에 한번 충돌할 때마다 가하는 힘은 같다.
⑤ 온도가 같으면 단원자 기체 1몰이 갖는 에너지는 기체의 종류와 무관하게 같은 값을 갖는다.
답 : 4
3. 다음 반응식 중 균형이 맞은 것은?
①

②

③
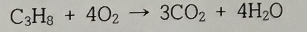
④

⑤

답 : 5
4. 화합물 NO, N2H4, N2O, Li3N에 들어 있는 N 원자의 산화수에 해당하지 않는 것은?
① -3
② -2
③ -1
④ +1
⑤ +2
답 : 3
5. 화학반응에 대한 다음 설명 중 옳지 않은 것은?
① 전자를 잃는 원자를 포함한 화학종이 환원제이다.
② 침전 반응의 알짜 반응식에는 구경꾼 이온들이 존재한다.
③ 화학종 간에 양성자를 주고받는 반응은 산-염기 반응이다.
④ 두 이온화합물 수용액을 섞을 때 침전이 생성될지는 예측할 수 있다.
⑤ 공유결합 화합물 중의 특정 원자의 산화수는 그 원자의 실제 전하가 아니다.
답 : 2
6. 다음 설명 중 옳은 것은?
① 물에 용해된 이온 화합물은 모두 이온화한다.
② 물이 자체 이온화하기 때문에 물에는 전류가 흐른다.
③ 수용액에 전류를 흘리는 전자들이 이동하면서 전류가 흐른다.
④ 수용액 중의 양이온과 음이온들은 모두 쌍을 이루어 움직인다.
⑤ 용융된 NaCl에는 이동할 수 있는 이온이 없어 전류가 흐르지 않는다.
답 : 1
<단답형 문항 : 각 5점> : 단답형 문제는 풀이 과정이 없이 최종 답만을 답안지의 해당 란에 쓰세요.
1. KHP(KHC8H4O4) 0.4016g을 녹인 수용액을 적정하는 데 NaOH 용액 25.00mL가 소모되었다. NaOH 수용액의 몰농도를 구하라.
답 : 0.0787M
2. 질산 은(AgNO3) 수용액에 아연(Zn)을 넣으면 금속 은과 질산 아연 (Zn(NO3)2)이 생긴다. 금속 아연 19.00g을 과량의 질산 은 수용액이 든 비커에 넣었다. 아연이 일부 남아 있을 때 반응을 중단하고 비커 속의 금속(아연 + 은)의 질량을 측정하였더니 29.00g이었다. 금속 혼합물 중의 은의 질량을 g 단위로 구하라.
답 : 14.4g
3. 0.300 M NaHCO3 용액 250.0 mL를 만들려고 한다. 250.0mL 용량 플라스크에 넣어야 할 NaHCO3의 질량을 구하라.
답 : 6.3g
4. 1000℃의 엔진 내부에 들어 있는 N2 분자와 25℃의 H2의 제곱 평균근 속도의 비를 구하라. 반드시 큰값/작은 값의 비를 답란에 써라.
답 : 1.8
5. 27℃, 2.00L 용기에 CO2 215g(4.89 mol)이 들어있다. 이상기체 법칙과 van der Waals 식으로 구한 압력의 차이를 atm 단위로 써라. 단, CO2 기체의 a=3.59(atm*L^2)/mol^2, b=0.0427L/mol이다.
답 : 14.5 atm
6. 68.0℉를 섭씨 온도로 환산하라.
답 : 20℃
< 주관식 문항 : 각 10점>
주의 : 주관식 문제는 풀이 과정이 없으면 부정행위로 간주하여 0점 처리합니다. 답안지 칸이 부족하면 답안지 뒷면을 이용하세요.
1. 어떤 연료 1.500g을 태워 얻은 SO2 기체를 다음과 같이 과산화수소와 반응시켜 모두 황산으로 변화시켰다.

이 황산을 중화하는 데 0.1000M NaOH 수용액 23.44mL가 쓰였다. 연료 중의 황의 질량 백분율을 구하라. 단, H2SO5 1몰은 NaOH 2몰과 반응한다.
답 : 2.51%
2. B5H9과 산소 혼합물을 로켓 연료로 사용한다. 두 물질은 다음과 같이 반응한다.

B5H9과 126.0g을 산소 192.0g과 반응시켰다. 생성된 수증기의 질량을 g 단위로 구하라.
단, 반응 수득률은 100%이다.
답 : 81g
3. SiH4는 다음 두 단계 반응으로 만든다.

a. 10.00atm, 35℃에서 HCl 15.00L를 써서 HSiCl3(d=1.34g/mL) 156.0mL를 얻었다면 HSiCl3의 퍼센트 수율은 얼마인가? (5점)
b. HSiCl3 156.0mL를 사용하여 반응 (b)를 통하여 SiH4를 얻었다. 퍼센트 수율이 93.1%라면 10.00atm, 35℃에서 생성된 SiH4의 부피는 얼마인가 L 단위로 구하라. (5점)
답.
(a) 78.1%
(b) 0.91L
4. C, H, N, O를 포함하는 어떤 유기화합물 0.1023g을 완전히 연소시켜 CO2 0.2766g, H2O 0.0991g을 얻었다. 또한, 같은 시료 0.4831g을 써서 Dumas 법으로 시료 중의 질소를 분석하여 STP에서 N2 기체 27.6mL를 얻었다.
a. 이 화합물의 실험식을 구하라. (6점)
b. 127℃, 256.0 Torr에서 이 시료 기체의 밀도가 4.020g/L였다. 이 화합물의 분자식을 구하라. (4점)
답.
(a) C12H21ON
(b) C24H42O2N2
'화학1 족보' 카테고리의 다른 글
화학 1 “2017년 1학기 기말 시험” (1) 2020.05.26 화학 1 “2016년 1학기 기말 시험” (0) 2020.05.26 화학 1 “2015년 1학기 기말 시험” (1) 2020.05.26 화학 1 “2016년 1학기 중간 시험” (0) 2020.04.19 화학 1 “2015년 1학기 중간 시험” (2) 2020.04.19