-
화학 1 “2016년 1학기 중간 시험”화학1 족보 2020. 4. 19. 18:47
화학 1 “2016년 1학기 중간 시험”
<5지 선다형 : 각 문항 5점>
1. 실제 기체의 비이상성에 대한 다음 설명 중 옳은 것을 모두 고른 것은?
① ㄱ, ㄴ
② ㄴ, ㄷ
③ ㄴ, ㄹ
④ ㄷ, ㄹ
⑤ ㄱ, ㄴ, ㄹ
ㄱ : PV/nRT 값이 클수록 더 쉽게 압축된다.
ㄴ : 압력이 증가함에 따라 분자의 크기 효과는 더 커진다.
ㄷ : 다른 조건이 같으면 b 값이 클수록 더 쉽게 압축된다.
ㄹ : 모든 분자 간에는 van der Waals 힘이 항상 작용하고 있다.
답 : 3
2. 다음 두 용어의 연관성이 가장 적은 것은?
① 우연오차 – 정밀도
② 질량수 – 원자번호
③ 실험식 – 화합물 조성
④ 전자 전하 – 기름방울 실험
⑤ 동위원소 – 질량 분석계
답 : 2
3. 아래 그림은 압력에 따른 몇 가지 기체의 PV/nRT 곡선이다. 이 그림으로부터 알 수 있는 것이 아닌 것은?
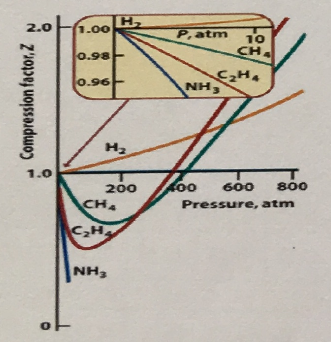
① CH4의 a 값은 H2의 a 값보다 크다.
② CH4의 b 값은 C2H4의 b 값보다 작다.
③ H2는 크기가 작아 모든 압력 범위에서 C2H4보다 더 쉽게 압축된다.
④ 압력이 증가함에 따라 PV/nRT 값이 작아지는 것은 분자간 인력 때문이다.
⑤ 600 기압에서 1L 용기 속에 들어있는 C2H4의 분자는 같은 조건의 H2 기체보다 많다.
답 : 3,5 (하나만 골라도 정답, 문제 오류)
4. 화학반응에 대한 다음 설명 중 옳은 것은?
① 모든 산화-환원 반응의 알짜 반응은 같다.
② 이온화합물 수용액을 섞으면 항상 침전이 생성된다.
③ 침전 반응에서는 새로운 화학결합이 생기지 않는다.
④ 화학종 간에 전자를 주고받는 반응은 산-염기 반응이다.
⑤ 산화수가 증가하는 원자를 포함하는 화학종이 환원제이다.
답 : 5
5. 다음 설명 중 옳은 것은?
① 물 분자의 큰 극성 때문에 물에는 전류가 흐른다.
② 모든 분자 화합물은 물에 녹아도 이온화하지 않는다.
③ 수용액 중의 양이온과 음이온들은 모두 쌍을 이루어 움직인다.
④ 수용액에 전류를 흘리면 이온들이 이동하면서 전류가 흐른다.
⑤ 용융된 NaCl에는 수화된 이온이 없어 전류가 흐르지 않는다.
답 : 4
6. 다음 중 기체 분자운동론으로 유도하거나 구할 수 있는 것이 아닌 것은?
① 기체의 압력
② 기체의 부피
③ 이상기체 법칙
④ 기체 분자의 평균 속력
⑤ 특정 속도를 갖는 기체 분자의 분율
답 : 2
<단답형 문항 : 각 5점>: 단답형 문제는 풀이 과정이 없이 최종 답만을 답안지의 해당 란에 쓰세요.
1. 0.350M NaOH 용액 25.0mL를 중화하는 데 필요한 0.150M H2SO4 용액의 부피는 몇 mL인가?
답 : 29.1
2. 반응
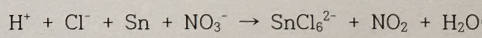
에는 환원제를 써라.
답 : Sn
3. 길이 25.0cm 유리관의 왼쪽에 암모니아를, 오른쪽에 염산을 적신 솜 마개를 동시에 끼우면 조금 지나 유리관 내부에 염화암모늄의 흰 고리가 생긴다. 이 흰 고리는 유리관 왼쪽에서 몇 cm 위치에 생길 것으로 예상되는가? 단, 기체 분자의 확산 속도는 유리관 내부에 들어 있는 공기의 영향을 받지 않는다고 가정한다.
답 : 14.8
4. 1000℃의 엔진 내부에 들어 있는 N2 분자의 제곱 평균근 속도를 m/s 단위로 구하라.
답 : 1064.9
5. 1.50atm, 327℃의 BF3 기체의 밀도를 g/L 단위로 구하라.
답 : 2.07
6. 다음 계산의 결과를 정확한 유효숫자 개수로 반올림하여 그 값과 단위를 답란에 쓰시오.
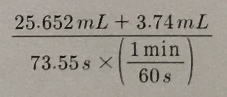
답 : 23.97 mL/min
<주관식 문항 : 각 10점>
주의 : 주관식 문제는 풀이 과정이 없으면 부정행위로 간주하여 0점 처리합니다. 답안지 칸이 부족하면 답안지 뒷면을 이용하세요.
1. 어떤 연료 1.325g을 태워 얻은 SO2 기체를 다음과 같이 과산화수소와 반응시켜 모두 황산으로 변화시켰다.
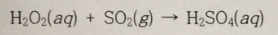
이 황산을 중화하는 데 0.1000M NaOH 수용액 28.44mL가 쓰였다. 연료 중의 황의 질량 백분율을 구하라. 단, H2SO4 1몰은 NaOH 2몰과 반응한다.
답 : 3.44%
2. 에테인(C2H6) 기체와 염소(Cl2) 기체가 반응하여 HCl과 C2H5Cl을 생성한다. 특정 조건에서 이 반응의 퍼센트 수율은 73.0%이다. 이 조건에서 에테인 300.g과 염소 650.g이 반응하여 생성되는 C2H5Cl의 질량을 구하라.
답 : 431.7298g
3. 질산 존재 하에

는
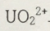
로 바뀌면서 NO 기체가 발생한다.

a. 반응식의 균형을 맞추어라. 답만 쓰시오.(6점)
b. 29℃, 1.50atm에서 NO 기체 2.55 * 10^2mL가 생성되었다. 반응한 UO2+의 몰수를 구하라. (4점)
답.
a :
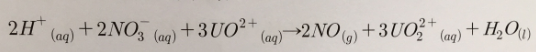
b : 0.023mol UO2+ (풀이에 NO 언급 없으면 1점 감점)
4. C, H, N 만을 포함하는 화합물에서 질량비로 C는 58.51%, H는 7.37%이다. 또 헬륨의 분출속도는 이 화합물보다 3.20배 빠르다.
a . 이 화합물이 실험식을 구하라. (6점)
b. 이 화합물의 분자식을 구하라. (4점)
답.
a : C2H3N
b : C2H3N
'화학1 족보' 카테고리의 다른 글
화학 1 “2017년 1학기 기말 시험” (1) 2020.05.26 화학 1 “2016년 1학기 기말 시험” (0) 2020.05.26 화학 1 “2015년 1학기 기말 시험” (1) 2020.05.26 화학 1 “2017년 1학기 중간 시험” (5) 2020.04.19 화학 1 “2015년 1학기 중간 시험” (2) 2020.04.19