-
화학 1 “2015년 1학기 중간 시험”화학1 족보 2020. 4. 19. 18:00
화학 1 “2015년 1학기 중간 시험”
<5지 선다형: 각 문항 5점>
1. 기체에 대한 다음 설명 중 옳지 않은 것은?
① 분자간 인력이 강할수록 더 쉽게 압축된다.
② 분자의 크기가 작을수록 더 쉽게 압축된다.
③ PV/nRT 값이 작을수록 더 쉽게 압축된다.
④ 압력이 증가함에 따라 분자의 크기 효과가 더 크게 나타난다.
⑤ 분자간 인력이 큰 기체는 모든 압력에서 인력이 작은 기체보다 더 쉽게 압축된다.
답 : 5
2. 다음 설명 중 옳지 않은 것은?
① -40℃와 -40℉는 같은 온도이다.
② 자연 법칙은 이론적으로 증명된 가설이다.
③ 계통 오차가 큰 측정에서도 정밀도가 높을 수 있다.
④ 새로운 실험 결과에 의해 이론이 수정 또는 폐기 될 수 있다.
⑤ Rutherford는 원자에 양의 전하를 띤 핵이 존재함을 처음으로 밝혔다.
답 : 2
3. 다음 중 Dalton의 원자론의 내용이 아닌 것은?
① 같은 원소의 원자는 모두 같다.
② 화학 반응은 원자들이 재배열되는 과정이다.
③ 화합물은 서로 다른 원소의 원자들이 결합하여 형성된다.
④ 한 화합물에는 항상 같은 원자들이 일정한 비율로 들어 있다.
⑤ 두 원소가 화합물을 형성할 때 두 원소의 질량비는 항상 일정하다.
답 : 5
4. 다음 반응과 반응의 종류를 짝지은 것 중 옳은 것은?
① H2 + Cl2 → 2HCl : 산-염기 반응
② Fe + 2HCl → FeCl2 + H2: 산-염기 반응
③ CH4 + F2 → HF + CH3F : 산화-환원 반응
④ H3O+(aq) + OH-(aq) → 2H2O(l) : 산화-환원 반응
⑤ 2Al(s) + 6H2O(g) → 2Al(OH)3(s) + 3H2(g) : 침전 반응
답 : 3
5. 수용액에 대한 다음 설명 중 옳지 않은 것은?
① 센 전해질은 수용액에서 거의 완전히 이온화한다.
② 이온 화합물인 NaCl 결정에는 전기가 잘 흐른다.
③ 수용액 중의 양이온과 음이온들은 모두 수화되어 있다.
④ 약한 염기인 NH3 수용액에서 NH3 분자는 대부분 분자로 존재한다.
⑤ 센 전해질 수용액에 전기를 흘리면 이온들이 이동하면서 전류가 흐른다.
답 : 2
6. 다음 기체의 성질 중 이상기체와 실제기체가 공통적으로 가지고 있는 성질이 아닌 것은?
① 분자가 질량을 가지고 있다.
② 분자들이 운동에너지를 가지고 있다.
③ 분자들이 지속적으로 움직이고 있다.
④ 분자들끼리 서로 지속적으로 충돌하고 있다.
⑤ 분자가 용기의 벽에 충돌할 때 벽에 가하는 힘에 의해 압력이 나타난다.
답 : 4
<단답형 문항 : 각 5점> : 단답형 문제는 풀이 과정이 없이 최종 답만을 답안지의 해당 란에 쓰세요.
1. 고체 수산화 리튬은 다음과 같이 이산화 탄소와 반응한다.

수산화 리튬 1.00 kg으로 제거할 수 있는 이산화 탄소의 질량을 구하라.
답 : 0.92Kg
2. 프탈산 수소 포타슘(KHC8H4O4) 1.500g을 녹인 수용액을 적정하는 데 수산화 소듐 수용액 42.00mL가 소요되었다. 이 수산화 소듐 용액의 몰농도를 구하라.

답 : 0.175M
3. 암모니아 기체를 공기 중에서 연소 시키면 NO2 기체와 물(액체)을 생성한다. 이 반응의 균형 맞춘 반응식을 써라.
답 :

4. 구리(1) 이온과 산화 이온으로 이루어진 화합물의 화학식을 쓰시오.
답 : Cu2O
5. 1.50 atm, 27℃의 기체의 밀도를 측정하였더니 1.706g/L이었다. 이 기체의 분자량을 구하라.
답 : 28.0g/mol
6. He과 UF6 기체의 제곱 평균근 속도가 같을 때 두 기체의 온도 비

를 구하라.
답 : 88
<주관식 문항 : 각 10점>
주의 : 주관식 문제는 풀이 과정이 없으면 부정행위로 간주하여 0점 처리합니다. 답안지 칸이 부족하면 답안지 뒷면을 이용하세요.
1. 식물의 열매에 들어 있는 어떤 화합물을 분리하여 원소 분석을 행하여 탄소 49.48%, 수소 5.15%, 질소 28.87%, 산소 16.49%로 이루어졌음을 알았다.
a. 이 화합물의 실험식을 구하라(6점)
b. 이 화합물의 분자량을 측정하였더니 194.2g이었다. 이 화합물의 분자식을 구하라(4점)
a. 답 : C4H5N2O
b. 답 : C8H10N4O2
2. 고온의 고체 산화 구리(2) 위에 암모니아를 흘리면 고체 구리, 질소 기체, 수증기가 생성된다. NH3 10.0g이 CuO 90.0g과 반응할 때 생성되는 N2의 질량을 구하라.
답 : NH3가 한계반응물, 8.26g N2
3. 고체 염소산 포타슘(KClO3)을 시험관에 넣고 가열하면 다음 반응과 같이 분해된다.
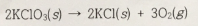
전체 압력이 754 torr이고 온도가 22℃인 조건에서 생성된 산소를 수상 치환으로 모았다. 포집된 기체의 부피는 0.650L이고, 22℃에서 물의 증기압은 21 torr이다. 분해된 KClO3의 질량을 구하라. 단, 부반응은 없으며 산소를 이상 기체로 가정한다.
답 : 2.12g KClO3
4. 반응 에 대하여
a. 가장 큰 산화수를 갖는 원자(또는 원자를 포함하는 화학종을 찾아쓰고 해당 원자의 산화수를 표기하라.(3점)
b. 위 반응의 균형을 맞추어라.(5점)
c. 위 반응에서 산화제로 작용한 화학종을 찾아 써라.(2점)
* 주의 : 이 문제는 a의 답이 틀리면 뒷 문제의 답이 정답이라도 0점으로 채점합니다.
답 : a. N: +5
b.

c.

'화학1 족보' 카테고리의 다른 글
화학 1 “2017년 1학기 기말 시험” (1) 2020.05.26 화학 1 “2016년 1학기 기말 시험” (0) 2020.05.26 화학 1 “2015년 1학기 기말 시험” (1) 2020.05.26 화학 1 “2017년 1학기 중간 시험” (5) 2020.04.19 화학 1 “2016년 1학기 중간 시험” (0) 2020.04.19