-
화학 2 “2015년 동계절학기 중간 시험”화학2 족보 2020. 10. 6. 22:13


1. 그림은 물과 이산화탄소의 상평형 그림이다. 이 그림에 대한 설명 중 옳지 않는 것은?

① 일반적으로 고체는 저온 고압에서, 기체는 고온 저압에서 안정하다.
② 임계압력영역에서 압력을 가하면 증기는 응축된다.
③ 점 A의 상태에 있는 얼음의 온도는 일정하게 유지하면서 압력을 변화시켜 액체로 만들 수 있다.
④ 점 B의 상태에 있는 이산화탄소의 압력을 일정하게 유지하면서 온도를 낮추면 액체를 거치지 않고 고체로 변한다.
⑤ 선상의 점들은 두 상들이 평형을 이루며 공존하는 압력과 온도이다.
답 : 2
2. 다음 설명 중 옳지 않은 것은?
① I2는 Cl2보다 더 큰 분산력을 나타낸다.
② 분자간의 힘이 약하면 그 물질의 증기압은 높고 녹는점은 낮아진다.
③ 분자 간 큰 힘을 가진 액체는 상대적으로 높은 표면장력을 갖는 경향이 있다.
④ 면심입방체의 배위수는 12이며, 단위세포 내 4개의 입자가 들어있다.
⑤ HCl에 존재하는 주된 분자간 힘은 수소 결합이다.
답 : 5
3. 다음의 설명 중 옳은 것은?
① 흑연의 전도성은 비편재화된 π-전자의 존재로 설명된다.
② 석영의 SiO2는 독립체로 존재한다.
③ 입방 최조밀 쌓임 구조를 갖는 NaCl은 단위세포 내에 2개의 Na- 이온을 갖고 있다.
④ 녹는점에서 액체의 증기압은 고체의 것보다 크다.
⑤ CH3OCH3의 끓는점은 CH3CH2OH보다 높다.
답 : 14. 다음 설명 중 옳지 않은 것은?
① 이온화합물의 용해열이 흡열과정이라도 자발적으로 물에 용해될 수 있다.
② 비극성 용질과 극성 용매로 이루어진 용액의 용해열은 큰 음의 값을 가져 잘 섞는다.
③ 온도가 증가하면 삼투압은 작아진다.
④ 비휘발성 용질은 용매의 증기압을 낮춘다.
⑤ 아세톤-물로 이루어진 용액은 수소결합을 이루어 Raoult의 법칙으로부터 음의 편차가 예상된다.
답 : 2, 3
5. 반응속도에 대한 다음 설명 중 옳은 것은?
① 메커니즘의 각 단일단계 반응의 속도법칙은 실험으로 구한다.
② 촉매는 반응의 메커니즘을 변화시켜 정반응의 속도만 증가시킨다.
③ 반응의 중간체는 일반적으로 전체 균형 반응식에는 나타나지 않지만 때로는 분리가 가능하다.
④ 0차 반응의 반감기는 초기농도에 반비례한다.
⑤ 2NO2 + F2 → 2NO2F 반응에서 NO2 분자 2개와 F2 분자 1개가 동시에 충돌하여 NO2F 분자 2개를 만든다.
답 : 3
6. A → B인 일차 반응에 대한 설명 중 옳지 않은 것은?
① A의 농도를 2배로 하면 속도는 2배로 증가한다.
② ln[A]t와 시간 t의 그래프는 직선이다.
③ 이 반응의 속도상수의 단위는 mol*L^-1*s^-1이다.
④ 이 반응의 반감기는 A의 농도와는 무관하다.
⑤ 반응의 온도를 10℃ 증가시키면 반응속도는 대략 2배 증가한다.
답 : 3
8. 다음 각 반응이 평형에 도달한 후 전체 부피를 인위적으로 증가시켰을 때, 생성물이 증가하는 반응들로 이루어진 것은?

① ㄱ
② ㄴ
③ ㄷ
④ ㄱ, ㄴ
⑤ ㄴ, ㄷ
답 : 1
(단답형)
1. 질량백분율이 8.00% NH3 용액 (NH3 : 17.0g/mol), 밀도 = 0.97g/mL)의 몰농도(M)와 몰랄농도(m)는 얼마인가?
답 : M : 4.56, m : 5.11
2. 몰질량이 95.2g/mol인 어떤 이온화합물 0.952g을 물 100.0g에 녹인 수용액의 어는점을 측정하였더니 -0.43℃였다. 이 수용액에 들어있는 이온화합물의 van't Hoff 인자 값은? 단, 물의 Kf 값은 1.86℃ kg/mol이고 이상용액으로 가정한다.
답 : 2.31
3. 25℃에서 A와 B가 각각 0.77몰, 0.23몰이 들어있는 용액에서 증발한 증기에 들어 있는 A의 몰분율을 구하라.
(단, 이 온도에서 순수한 A와 B의 증기압은 각각 95.1 torr와 28.4 torr이고, 이상용액으로 가정하라)
답 : 0.92
4. 에탄올의 증기압이 34.7℃에서 100mmHg이고 증발열은 38.6kJ/mol이다. 78.4℃에서 에탄올의 증기압은 얼마인가?답 : 653mmHg
5. 어떤 온도에서 NO2(g) + CO(g) → NO(g) + CO2(g) 반응은 NO2에 대해 2차 반응이며, 속도상수는 0.50L/mol*s이다. NO2의 초기 농도가 0.2M일 때, NO2의 농도가 초기 농도의 1/3이 되는데 걸리는 시간은(sec)?
답 : 20 sec
6. 어떤 박테리아 유전자 조각을 분리하여 시료 10.0mg을 물에 녹여 30.0mL 용액을 만들었따. 이 용액의 삼투압은 25℃에서 0.340 torr이다. 이 유전자 조각의 몰 질량은 얼마인가?
답 : 1.82 x 10^4g/mol
7.

의 반응에서 PCl5 = 0.105mol, PCl3 0.045mol, Cl2 0.045mol을 250℃에서 500mL 용기에 섞었다. (Kc= 0.042). 평형에서 [PCl5] = 0.2065M일 때, PCl3의 몰농도는? (8점)
답 : 0.0935
8. 어떤 온도에서 반응용기에 기체 A 1.00 atm과 충분한 양의 C를 넣고 A(g) + C(g) ↔ 2B(g) 반응이 평형에 도달하도록 하였다. 평형에 도달한 후 A의 분압은(atm 단위로)을 구하라. 단, 이 온도에서 이 반응의 평형상수 Kp=2.00이다.
답 : 0.5
1. 어떤 원자의 밀도가 10.6g/cm^3이고 반지름은 144pm이며, 결정구조는 입방 최조밀 쌓음 구조이다.(10점)
a) 단위세포 ?
b) 입방체의 부피는 ?
c) 이 원자의 몰질량 ?
답 :
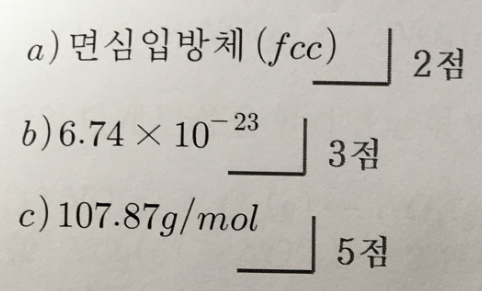
2. (10점)
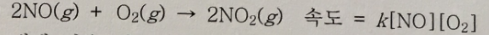
위 반응에 대해 다음 메커니즘이 제안되었다. 이 메커니즘의 타당성을 반응식과 분자도, 중간체 및 단계반응의 속도를 이용하여 검토하라. (10점)
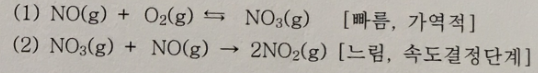
답 :


'화학2 족보' 카테고리의 다른 글
화학 2 “2016년 동계절학기 중간 시험” (1) 2020.10.06 화학 2 “2014년 2학기 중간 시험” (3) 2020.10.06 화학 2 “2016년 2학기 중간 시험” (0) 2020.10.05 화학 2 “2015년 2학기 중간 시험” (3) 2020.10.05