-
화학 2 “2014년 2학기 중간 시험”화학2 족보 2020. 10. 6. 20:16
화학 2 “2014년 2학기 중간 시험”


< 5지 선다형 : 각 문항 5점 >
1. PCl5를 용기에 넣고 가열하여 다음 반응이 평형에 도달하였다.

어떤 온도에서의 평형에서 전체 압력은 3.0기압이며 Cl2 기체의 몰분율은 0.40이었다. 이 계에 대한 설명으로 옳은 것은?
① PCl5의 분압은 0.40 기압이다.
② 평형 상수(Kp)는 2.40이다.
③ Cl2를 첨가하면 PCl3의 양은 증가한다.
④ 일정한 압력에서 온도를 올리면 PCl3의 몰분율은 감소한다.
⑤ 일정한 온도에서 용기를 압축하면 평형 상수는 감소한다.
답 : 2
2. 다음 설명 중 옳지 않은 것은?
① 분산력은 모든 분자 간에 작용한다.
② 단순입방 구조의 배위수는 6이다.
③ 이온-쌍극자 인력은 이온의 전하가 클수록 강하다.
④ 물에 대한 용해엔탈피가 양(+)인 물질은 물에 녹지 않는다.
⑤ 액체 상의 극성 분자 간에 작용하는 주된 인력은 분산력이다.
답 : 4
3. 그림은 이산화탄소와 물의 상평형 그림이다. 이 그림에 대한 설명 중 옳지 않는 것은?

① 점 A의 상태에 있는 얼음의 온도는 일정하게 유지하면서 압력을 변화시켜 액체로 만들 수 있다.
② 점 B의 상태에 있는 이산화탄소의 압력을 일정하게 유지하면서 온도를 낮추면 액체를 거치지 않고 고체로 변한다.
③ 고체 이산화탄소의 밀도는 액체 이산화탄소보다 높다.
④ 40℃, 80atm에서 이산화탄소는 초임계유체 상태로 존재한다.
⑤ 두 상평형 그림에서 고체-액체 상경계는 냉각 곡선과 같다.
답 : 5
4. 다음 설명 중 옳지 않은 것은?
① 농도가 일정하여도 온도가 높아지면 삼투압도 높아진다.
② 분자간 인력이 없으면 항상 기체로 존재한다.
③ Raoult의 법칙을 따르는 용액을 이상용액이라 부른다.
④ 물에 대한 이온화합물의 용해열은 격자에너지와 수화엔탈피의 합이다.
⑤ 삼중점 이하의 온도에서 물은 기체 상태로 존재할 수 없다.
답 : 5
5. 화학 평형에 대한 다음 설명 중 옳지 않은 것은?
① 평형 상태에서는 정반응과 역반응이 같은 속도로 일어난다.
② 흡열반응에서 온도를 올리면 K가 감소한다.
③ 반응식에 2를 곱하면 평형상수는 제곱이 된다.
④ 일정한 온도의 기체상에서 2NO2 ↔ N2O4 반응이 평형을 이룬 계에 N2를 가하여도 NO2의 양은 그대로이다.
⑤

반응이 평형에 도달한 계에 황(S)을 첨가하여도 [H2O]는 변하지 않는다.
답 : 2
6. 반응 속도에 대한 다음 설명 중 옳지 않은 것은?
① 온도 증가에 따른 반응 속도 증가는 단위 시간당 충돌횟수 증가 때문이다.
② 1차 반응의 속도상수의 단위는 s^-1이다.
③ 정반응의 활성화 에너지가 역반응보다 작은 반응은 발열반응이다.
④ 2차 반응의 반감기는 초기 농도에 반비례한다.
⑤ 단일 단계반응의 속도법칙은 반응식으로부터 바로 알 수 있다.
답 : 1
<단답형 문항 : 각 5점 > : 단답형 문제는 풀이 과정이 없이 최종 답만을 답안지의 해당 란에 쓰세오.
1. 염화 마그네슘(MgCl2) 0.952g을 물 100.0g에 녹였다. 이 용액의 표준 어는점을 구하라. 단, 이 용액의 van't Hoff 인자는 2.70이고, 물의 Kf값은 1.86℃/m이다. (5점)
답 : -0.502℃
2. 35℃에서 C2H5OH의 증기압은 115Tor이고, 표준 끓는점은 78.0℃이다. 에탄올의 증발엔탈피를 kJ/mol 단위로 구하라.
답 : 39.5 kJ/mol
3. 7℃에서 포도당(C6H12O6) 54.0g을 물 1.00L에 녹인 수용액과 증류수로 삼투압 실험을 하면 충분한 시간이 흐른 후 액체 기둥이 몇 cm나 얼마나 올라갈까? 단, 포도당 용액의 밀도는 1.00g/mL이라 가정.
답 : 7121cm
4. 25℃에서 벤젠과 톨루엔이 몰수로 2:1로 들어 있는 용액에서 증발한 증기에 들어 있는 벤젠과 톨루엔의 몰분율을 구하라. 단, 이 온도에서 벤젠과 톨루엔의 증기압은 각각 95.0 Torr와 30.0 Torr이다.
답 : 벤젠 : 0.86, 톨루엔 0.14
5. 어떤 온도에서 반응용기에 기체 A 1.00 atm과 충분한 양의 C를 넣고 A(g)+ C(s) ↔ 2B(g) 반응이 평형에 도달하도록 하였다. 평형에 도달한 후 A의 분압은(atm 단위로)을 구하라. 단, 이 온도에서 이 반응의 편형상수 Kp = 10.0이다.
답 : 0.234 atm
6. 어떤 진한 염산 시료의 몰농도는 12.00 M이다. 이 용액에서 HCl의 몰분율은 얼마인가. 단, 수용액의 밀도는 1.20g/mL임
답 : 0.221
< 주관식 문항 : 각 10점 >
주의 : 주관식 문제는 풀이 과정이 없으면 부정행위로 간주하여 0점 처리합니다. 답안지 칸이 부족하면 답안지 뒷면을 이용하세요.
1.(10점) Cr은 체심입방 구조를 가지며, 원자 반지름은 128pm이다. 다음 물음에 답하라.
(a) 채움 효율을 구하라. (5점) (반드시 계산 과정을 보이시오.)
(b) 밀도를 구하라. (5점)
답 :
(a)
(b)

2.(10점) 반응물 A가 1차 반응으로 생성물 B로 변화하는 과정을 아래 그림으로 나타내었다.

a. 속도상수 k를 구하라. (4점)
b. 반응의 반감기 t1/2를 구하라. (3점)
c. 초기 반응물에서 반응물 분자가 3개 남을 때까지 걸리는 시간을 구하라. (3점)
답 :
(a)
(b)
(c)

3. (10점) 2NO(g) + O2(g) → 2NO(g), 속도 = k[NO]^2 [O2]
위 반응에 대해 다음 메커니즘이 제안되었다. 이 메커니즘의 타당성을 검토하라.
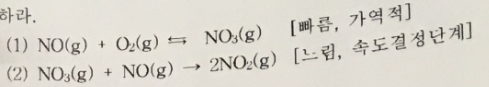
답 :

4. (10점) 그림은 어떤 반응의 속도 상수에 대한 Arrhenius 도시이다. 이 그래프의 직선의 기울기는 -22.7 x 10^3K이다. 다음 물음에 답하라. 이 그래프의 dm^3 = L이다.

a. 이 반응의 활성화 에너지를 kJ/mol 단위로 구하시오. (5점)
b. 지수 앞 인자 A의 값을 구하시오. (5점)
답 :
(a)
(b)

'화학2 족보' 카테고리의 다른 글
화학 2 “2015년 동계절학기 중간 시험” (4) 2020.10.06 화학 2 “2016년 동계절학기 중간 시험” (1) 2020.10.06 화학 2 “2016년 2학기 중간 시험” (0) 2020.10.05 화학 2 “2015년 2학기 중간 시험” (3) 2020.10.05