-
화학 2 “2016년 2학기 중간 시험”화학2 족보 2020. 10. 5. 23:31
화학 2 “2016년 2학기 중간 시험”

<5지 선다형 : 각 문항 5점 >
1. 용액과 총괄성에 대한 다음 설명 중 옳지 않은 것은?
① 설탕물을 얼려 만든 얼음 속에 들어 있는 설탕의 농도는 용액과 같다.
② 역삼투를 일으키기 위해서는 삼투압보다 더 높은 압력을 가해야 한다.
③ 비휘발성 용질이 녹은 용액의 증기압은 항상 순수한 용매보다 낮다.
④ 삼투압은 용매 분자의 무작위한 움직임 때문에 나타난다.
⑤ 소금물 용액이 얼기 시작하면 어는점은 점점 낮아진다.
답 : 1
2. 다음 설명 중 옳은 것은?
① 다이아몬드에는 π-결합만 존재한다.
② 육방 최조밀 쌓임 구조의 배위수는 8이다.
③ 물 분자 간에는 수소결합에 의한 인력만 작용한다.
④ 흑연에는 비편재화된 전자가 있기 때문에 전류가 흐른다.
⑤ 절연체에서는 채워진 MO와 빈 MO가 서로 닿아 있다.
답 : 4
3. 그림은 황의 상평형 그림이다. 이 그림에 대한 설명 중 옳지 않은 것은?
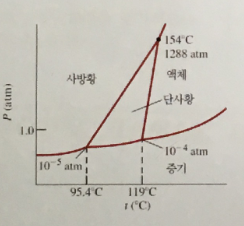
① 1기압, 110℃에서는 단사황이 가장 안정하다.
② 고체 황도 증기압을 갖는다.
③ 압력을 높이면 고체 황의 녹는점이 증가한다.
④ 이 상평형 그림에는 삼중점이 3개 있다.
⑤ 110℃에서 단사황에 충분한 압력을 가하면 액체로 녹는다.
답 : 5
4. 다음 설명 중 옳지 않은 것은?
① 분자(입자)간 인력이 없는 물질은 없다.
② 용액의 삼투압은 몰농도와 절대온도에 비례한다.
③ 어떤 용매에 녹는 모든 물질의 용해열은 (-) 값을 갖는다.
④ 임계점 이상의 온도와 압력에서 물은 기체 상태로 존재할 수 없다.
⑤ Si의 산화물이 분자를 형성하지 않는 것은 O-Si 사이의 π 결합 형성이 비효율적이기 때문이다.
답 : 3
5. 화학 평형에 대한 다음 설명 중 옳은 것은?
① 평형 상태에서는 반응이 일어나지 않는다.
② 역반응의 평형상수는 정반응 평형상수의 1/2 승이다.
③ 발열반응에서 온도를 올리면 역반응의 속도상수는 증가한다.
④ 2H2S(g) + O2(g) <-> 2S(s) + 2H2O(g) 반응이 평형에 도달한 계에 S를 첨가면 H2S의 양은 증가한다.
⑤ 일정한 온도의 기체상에서 2NO2 <-> N2O4 반응이 평형을 이룬 계를 피스톤으로 압축하면 N2O4의 양은 감소한다.
답 : 3
6. 반응 속도론에 관한 다음 설명 중 옳은 것은?
① mol * L^-1 * S^-1은 2차 반응의 속도상수의 단위이다.
② 단일 단계 반응의 속도법칙은 실험을 하지 않고도 알 수 있다.
③ 2차 반응에서 1/[생성물]은 시간에 따라 직선적으로 증가한다.
④ 정반응의 활성화 에너지가 역반응보다 작은 반응은 흡열반응이다.
⑤ 온도가 높아지면 분자들 간의 충돌 횟수가 증가하기 때문에 반응 속도가 증가한다.
답 : 2
<단답형 문항 : 각 5점 > : 단답형 문제는 풀이 과정이 없이 최종 답만을 답안지의 해당 란에 쓰세오.
1. 어떤 시료 0.500g을 물에 녹여 용액 100.0mL를 만들었다. 25℃에서 이 용액의 삼투압이 2.50atm이었다. 이 시료가 물에 녹을 때 2개의 입자로 해리한다면 이 시료의 몰질량은 얼마인가? 단. 이상용액이라고 가정한다.
답 : 97.8g/mol

2. 물의 증발엔탈피는 43.9kJ/mol이다. 60℃에서 물의 증기압을 torr 단위로 구하라.
답 : 141Torr

3. NaF의 용해엔탈피 △H용해 = +1.9kJ/mol이고 수화엔탈피 △H수화 = -927kJ/mol이다. 다음 과정의 엔탈피 변화를 구하라.

답 : 928.9kJ/mol

4. 다음은 염소 Cl2와 클로로포름 CHCl3 간의 반응에 대해 제안된 메커니즘이다. 이 반응의 속도법칙을 구하라.

답 : v = k[CHCl3][Cl2]^(1/2)

5. 900℃에서 다음 반응의 Kp = 1.04이다.

이 온도에서 5.00L 반응 용기에 충분한 양의 CaCO3를 넣고 계가 평형에 도달하였을 때 생성된 CaO의 몰수를 구하라.
답 : 0.0523mol

6. 어떤 반응에 대한 Arrhenius 도시에서 기울기가 -5024.7이고, y-절편이 -7.178인 직선이 얻어졌다. 이 반응의 활성화 에너지 Ea를 kJ/mol 단위로 구하라.
답 : 41.78kJ/mol

< 주관식 문항 : 각 10점 >
주의 : 주관식 문제는 풀이 과정이 없으면 부정행위로 간주하여 0점 처리합니다. 답안지 칸이 부족하면 답안지 뒷면을 이용하세요.
1. (10점) 그림은 NaCl의 단위세포의 모양이다. Na+ 이온과 Cl- 이온의 반지름은 각각 95.0 pm와 181pm이다.

(a) 단위 세포 중의 Na+ 이온과 Cl- 이온의 수를 구하라. (5점)
(b) NaCl 결정의 밀도를 g/mL 단위로 구하라. (5점)
답 :
(a)

(b)

2. (10점) 어떤 온도에서 3.00 L 용기에 SO3 기체 12.00mol을 넣었다. SO3 기체는 다음과 같이 해리한다.

이 온도에서 평형에 도달한 후 측정해보니 용기 속에 SO2 기체가 3.00mol 들어있었다.
(a) 이 온도에서 평형상수 K를 구하라. (4점)
(b) 평형에 도달한 계에 순간적으로 O2를 1.00 mol을 첨가하였다. 새로운 평형에 도달한 후의 [SO2]를 구하라. (6점)
답 :
(a)
(b)

3. (10점) 어떤 수용액의 어는점은 -2.79℃이다.
(a) 용질의 물분율을 구하라. (6점)
(b) 25℃에서 이 용액의 증기압을 구하라. (4점)
단, 이 온도에서 물의 증기압은 23.76 torr이다.
답 :
(a)
(b)

4. (10점) 어떤 온도에 aA → bB 반응에 대하여

일 때 시간에 대한 1/[A]를 도시하였더니 직선이 얻어졌고 그 기울기가 +3.60 * 10^-2L/mol*s였다.
(a) 반감기를 초 단위로 구하라. (5점)
(b) A의 농도가 7.0 * 10^-4M으로 감소하는데 걸리는 시간을 초 단위로 구하라. (5점)
답 :
(a)
(b)


'화학2 족보' 카테고리의 다른 글
화학 2 “2015년 동계절학기 중간 시험” (4) 2020.10.06 화학 2 “2016년 동계절학기 중간 시험” (1) 2020.10.06 화학 2 “2014년 2학기 중간 시험” (3) 2020.10.06 화학 2 “2015년 2학기 중간 시험” (3) 2020.10.05