-
일반 화학 “2017년 1학기 기말 시험”일반화학 족보 2020. 6. 14. 18:33
일반 화학 “2017년 1학기 기말 시험”

<5지 선다형 : 각 문항 5점>
1. 다음 설명 중 옳은 것은?
① 분자간 인력이 약한 분자는 항상 기체로 존재한다.
② 삼중점 이하의 온도와 압력에서 물은 액체 상태로 존재할 수 없다.
③ 온도 증가에 따라 삼투압이 높아지는 이유는 부피증가 때문이다.
④ 용매에 녹아 이온화하지 않는 용질의 용액을 이상용액이라 부른다.
⑤ 물에 대한 이온 화합물의 용해 과정의 엔탈피 변화는 이온화에너지와 수화열의 합이다.
답 : 2
2. 화학 결합에 대한 다음 설명 중 옳은 것은?
① 이온결합은 모두 부분 공유결합성을 갖는다.
② C=C의 결합 에너지는 C-C 결합에너지의 2배이다.
③ 결합 길이는 두 원자(또는 이온) 간의 퍼텐셜 에너지가 0인 거리이다.
④ 극성결합을 가진 분자는 모두 0이 아닌 쌍극자 모멘트를 갖는다.
⑤ 이온의 크기가 클수록 이온결합의 세기는 강하다.
답 : 1
3. 다음 설명 중 옳은 것은?
① 3p 궤도함수는 마디가 3개이다.
② n=3인 껍질 속에는 f 궤도함수가 없다.
③ 다전자 원자에서 궤도함수의 에너지는 n 값이 결정한다.
④ 2p 궤도함수에 전자가 1개 채워지면 이 전자는 항상 2px, 궤도함수에 들어간다.
⑤ 원자의 에너지 준위가 양자화되어 있음을 보여주는 실험적 증거는 광전효과이다.
답 : 2
4. 오른편 위의 그림은 황의 상평형 그림이다. 이 그림에 대한 설명 중 옳지 않은 것은?

① 고체 황에서도 승화현상이 일어난다.
② 이 상평형 그림에는 삼중점이 3개 있다.
③ 2기압, 95℃에서는 단사황이 가장 안정하다.
④ 외부 압력이 높아질수록 고체 황은 더 높은 온도에서 녹는다.
⑤ 110℃에서 단사황에 충분한 압력을 가하면 사방황으로 구조가 바뀐다.
답 : 3
<단답형 문항: 각 5점> : 단답형 문제는 풀이 과정이 없이 최종 답만을 답안지의 해당 란에 쓰세요.
1. 다음 결합 중에서 결합 에너지가 작은 것부터 차례로 나열하시오.
H-F, Cl-O, F-Cl, O-H
답 : Cl-O < F-Cl < O-H < H-F
2. 어떤 액체의 증기압을 여러 온도에서 측정하여 1/T에 대해 ln(P)의 그래프를 그렸더니 직선의 기울기가 -2406K이었다. 이 물질의 증발열을 kJ/mol 단위로 구하라.
답 : 20.003kJ/mol
3. 답안지에 d x^2-y^2 의 모양을 가능한 한 정확히 그리시오.
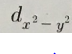
답 :

d orbital은 모양을 모두 외워놓는 것이 좋습니다. 개인적인 팁은 x, y, z 축을 기준으로 축에 어떻게 걸치는지를 생각해보시면 쉽게 외우실 수 있습니다.

4. 어떤 원소의 원자가 광속의 1.00% 속력으로 날아가고 있다. 이 원자의 de Broglie 파장을 측정하였더니 7.00x10^-3 pm이었다. 이 원소의 원소 기호를 쓰시오.
답 : F
5. NaF의 용해엔탈피 ΔH용해 = +1.9kJ/mol이고 수화엔탈피 ΔH수화 = -927kJ/mol이다. 다음 과정의 엔탈피 변화를 구하라.
NaF(s) → Na^+(g) + F^-(g)
답 : 928.9kJ/mol
6. 어떤 진한 질산 용액의 몰농도는 12.00M이다. 이 용액에서 HNO3의 몰랄농도를 구하라. 단, 이 진한 질산 용액의 밀도는 1.20g/mL임.
답 : 27.04m
7. 사이안산 이온은 NCO 순서로 결합되어 있다. 가능한 Lewis 구조 중 가장 안정할 것으로 예상되는 것의 Lewis 구조를 그리시오.
답 :

NCO 공명 구조는 추가로 외워 놓는게 좋습니다. 그래서 이미지 첨부합니다.
공명 구조의 Lewis 및 옥텟구조를 그려보는 연습을 하시면 좋습니다.

8. 다음 이온들 중에서 등전자 이온들을 찾아 그 크기가 증가하는 순서로 나열하시오.

Ca^2+, O^2-, K^+, Cl^-
답 : Ca^2+, K^+, Cl^-

<주관식 문항: 각 10점>
주의 : 주관식 문제는 풀이 과정이 없으면 부정행위로 간주하여 0점 처리합니다. 답안지 칸이 부족하면 답안지 뒷면을 이용하세요.
1. 다음 자료를 활용하여
Cl(g)의 전자 친화도 = -349kJ/mol
H2의 결합에너지 = 432kJ/mol
Li(s)의 승화열 = 166kJ/mol
Li(g)의 이온화 에너지 = 520kJ/mol
LiCl(s)의 격자 에너지 = -829kJ/mol
HCl의 결합에너지 = 427kJ/mol
다음 반응의 엔탈피 변화 ΔH를 구하라.(10점)
2Li(s) + 2HCl(g) → 2LiCl(s) + H2(g)
답 : 332+1040+854-432-698-1658 = -562kJ/mol

2. (10점) NaCl의 단위세포에서 Cl^- 이온이 완전한 면심입방구조를 갖는다고 가정하자. Na^+ 이온과 Cl^- 이온의 반지름은 각각 95.0pm와 181pm일 때,
(a) 단위 세포 중의 Na^+ 이온과 Cl^- 이온의 수를 구하라. (5점)
(b) NaCl 결정의 밀도를 g/mL 단위로 구하라. (5점)
답 :
(a) Na^+ 이온
모서리 = 12 x 1/4 = 3
중심 = 1
총 = 3+1 = 4
-2점
Cl^- 이온
면 = 6 x 1/2 = 3
꼭지점 = 8 x 1/8 = 1
총 = 3+1=4
-2점
(다맞으면 5점)
(b) 2.894g/mL

3. (10점) 어떤 수용액의 어는점은 -2.79℃이다. (이상용액으로 가정.)
(a) 용질의 몰분율을 구하라.(6점)
(b) 25℃에서 이 용액의 증기압을 구하라.(4점)
단, 이 온도에서 물의 증기압은 23.76torr 이다.
답 :
(a) : 0.026
2.79 = 1.86 x m
m = 1.5 = 몰수/용매(kg) = 1.5mol / 1kg
- 2점
물의 몰수 = 1kg / 18g/mol = 55.55mol
몰분율 = 1.5 / (55.5+1.5) = 0.026
- 4점
(b) : 23.14 Torr
23.76 Torr x 0.026 = 0.618
-2점
23.76 - 0.618 = 23.14 Torr
-2점
4. (10점) 실험적 연구에 의하면 N2O 분자는 선형이며 극성분자이다.
a. 문제에 주어진 실험적 자료를 이용하여 NNO와 NON 배열 중 어느 것이 옳은 배열인지 판단하라. (4점)
b. a의 답을 근거로 N2O의 Lewis 구조(공명구조 포함)를 그리고 각 원자의 형식 전하를 표시하라.(6점)
* 주의: 이 문제는 단계쩍으로 푸는 문제이므로 a의 답이 틀리면 뒷문제는 자동으로 0점으로 채점합니다.
답 :
(a) NNO 배열
N≡N과 N-O의 반데르발스힘의 차이가 있기 때문에 극성을 띈다. 하지만, NON배열에서 N=O의 반데르발스 힘 차이가 없기 때문에 무극성을 띈다.
따라서 선형, 극성 구조인 NNO배열이 옳은 배열이다.
-4점
(b)


'일반화학 족보' 카테고리의 다른 글
일반 화학 “2015년 1학기 기말 시험” (0) 2020.06.14 일반 화학 “2015년 1학기 기말 시험” (0) 2020.06.14 일반 화학 “2014년 2학기 기말 시험” (0) 2020.06.13 일반 화학 “2015년 2학기 기말 시험” (0) 2020.06.13 일반 화학 “2016년 2학기 중간 시험” (0) 2020.06.13