-
화학 1 “2014년 1학기 중간 시험”화학1 족보 2020. 6. 3. 01:10
화학 1 “2014년 1학기 중간 시험”

<5지 선다형 : 각 문항 5점>
1. 아래 그림은 압력에 따른 몇 가지 기체 1 mol의 압축인자 Z=PV/RT 곡선이다. 이 그림으로부터 알 수 있는 것을 올바로 설명한 것은?

① 이상기체의 Z 값은 항상 0이다.
② H2는 크기가 작아 모든 압력 범위에서 이상기체보다 더 쉽게 압축된다.
③ 압력이 증가함에 따라 Z 값이 작아지는 것은 분자의 크기 때문이다.
④ 100 기압에서 1L 용기 속에 들어있는 C2H4의 분자수는 같은 조건의 H2 기체보다 크다.
⑤ CH4의 b 값은 C2H4의 b 값보다 크다.
답 : 4
2. 다음 실험적 또는 경험적 사실 중 모든 물질이 원자로 이루어졌음을 보여주는 것이 아닌 것은?
① 모든 물질은 질량과 부피를 갖는다.
② 반응물과 생성물의 질량은 같다.
③ 이성질체가 존재한다.
④ 두 원소가 반응하여 두 화합물을 만들 때 일정한 질량의 A와 반응하는 B의 질량은 간단한 정수비로 표현된다.
⑤ 특정 화합물은 출처와 무관하게 구성 원소들의 질량 백분율이 일정하다.
답 : 1
3. 다음 반응에 참여하는 화합물 중의 각 원자의 산화수 중 옳지 않은 것은?

① Al = 0
② H in H2O(g) = -1
③ Al in Al(OH)3(s) = +3
④ O in Al(OH)3(s) = -2
⑤ H in H2 = 0
답 : 2
4. 다음 중 산화-환원 반응과 환원제가 올바르게 짝지어진 것은?
①

②

③

④

⑤

답 : 3
5. 0.10M NH3 수용액 100.0mL에 대한 다음 설명 중 옳은 것은?
① 0.050M Mg(OH)2 수용액과 전기를 흐르게 하는 능력이 같다.
② 이 수용액 중에는 NH3가 거의 존재하지 않는다.
③ 수용액 중에는 OH- 이온이 약 6.02 x 10^22 개 들어 있다.
④ 이 수용액에 H2SO4를 넣을 때 생성되는 염은 (NH4)2SO4이다.
⑤ 이 수용액을 HClO4 수용액으로 중화할 때 알짜 이온 반응식은 H+(aq) + OH-(aq) → H2O(l)이다.
답 : 4
6. 25℃, 1기압에서 다음과 같이 수소 기체 2 mol이 완전히 반응하는 과정의 내부에너지 변화 ΔE를 kJ 단위로 구하면? 단, 고체와 액체의 부피는 무시한다.

① +572.6
② -572.6
③ +565.2
④ -565.2
⑤ +580.0
답 : 4
<단답형 문항 : 각 5점> : 단답형 문제는 풀이 과정이 없이 최종 답만을 답안지의 해당 란에 쓰세요.
1. 실린더 내의 질소 1mol을 외부 압력을 1.00 atm을 유지하면서 0℃에서 800℃로 가열하였다. 이 과정의 일을 J 단위로 구하라.
답 : -6651J
2. 어떤 액체를 260℃에서 기화시켜 압력과 밀도를 측정하였더니 103 torr와 0.480g/L였다. 이 화합물의 분자량을 g/mol 단위로 구하시오.
답 : 154.9g/mol
3. NO2 기체는 물과 반응하여 질산(HNO3)과 NO 기체를 생성한다. 질산 10.0g을 얻기 위해 필요한 NO2 기체의 질량을 구하시오. 단, 수득률은 85.0%이다.
답 : 12.9g
4. 알루미늄 산화물의 화학식을 쓰시오.
답 : Al2O3
5. 다음 계산의 결과를 정확한 유효 숫자 개수로 반올림한 값을 답란에 쓰시오.

답 : 0.2755cm/ml
6. 질량분석을 통하여 실험식이 CH2N인 화합물의 분자량을 측정하였더니 140.0g/mol이었다. 이 화합물의 분자식을 쓰시오.
답 : C5H10N5
<주관식 문항 : 배점은 문항에 표시.>
주의 : 주관식 문제는 풀이 과정이 없으면 부정행위로 간주하여 0점 처리합니다. 답안지 칸이 부족하면 답안지 뒷면을 이용하세요.
1. 류머티스 관절염 치료제로 쓰는 코티솔(M=362.47g/mol)은 질량 백분율로 C 69.6%, H 8.34%, O 22.1%로 되어 있다. 코티솔의 실험식과 분자식을 구하라.(10점)답 :
코티솔(M=362.47g/mol) 1mol이 있다고 가정하고, 코티솔에 들어있는 C, H, O의 몰수 구하기

코티솔 1mol에 들어있는 C, H, O의 몰수비 21mol : 30 mol : 5mol
더이상 간단한 정수비로 나눌 수 없으므로 실험식은 C21H30O5 -4점
분자식도 실험식과 같음. C21H30O5 - 3점
2. 1.50atm, 300K에서 5.00L의 염소(Cl2) 기체가 포타슘(K) 20.0g과 반응하여 생성되는 염화포타슘의 질량은 얼마인가? 단, 부반응은 없다고 가정한다.(10점)
2K + Cl2 → 2KCl
Cl2가 한계반응물일 경우 생성되는 KCl의 몰수 계산하기

K가 한계반응물일 경우 생성되는 KCl의 몰수 계산하기

- 4점
그래서 더 적은 KCl을 만들어내는 K가 한계반응물이다. - 2점

- 4점
3. 원자화 엔탈피(열) ΔH˚원자 는 표준 상태에 있는 물질로부터 분리된 기체상 원자를 생성하는 데 필요한 열이다. 흑연의 원자화 반응식은 다음과 같다.
C(흑연) → C(g)
다음 자료를 이용하여 흑연의 ΔH˚원자를 구하라.
(1) CH4의 ΔH˚f = -74.9kJ/mol
(2) CH4의 ΔH˚원자 = 1660kJ/mol
(3) H2의 ΔH˚원자 = 432kJ/mol
답 :
(1), (2), (3)을 반응식으로 나타내기

구하고자 하는 것은 C(흑연)의 ΔH˚원자
(1) + (2) - 2 x (3)
-74.9kJ/mol + 1660kJ/mol - 2 x 432kJ/mol = 721.1kJ/mol -3점
∴ C(흑연) → C(g)
ΔH˚원자 = 721.1kJ/mol - 3점
4. 다음 그림은 침전 반응에서의 반응 용액을 표시한 것이다.
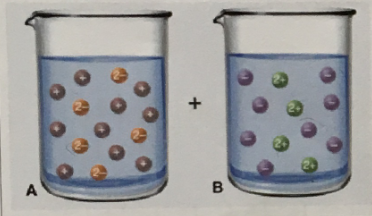
(a) 다음 중 각 용액에 들어 있는 화합물은 어느 것인가?

(b) 용액 A와 B를 혼합할 때 일어나는 반응의 알짜 이온 반응식을 쓰시오.
(c) 구 하나가 0.03 mol의 이온을 나타내고, 반응이 완결된다고 가정할 때 침전의 질량을 구하시오.
답 :
(a)
A : Na2SO4
B : Ba(NO3)2
- 2점
(b)

(c) 0.03mol 이온 4개를 가진 Ba(NO3)2가 한계반응물이다. - 1점



'화학1 족보' 카테고리의 다른 글
화학 1 “2014년 1학기 기말 시험” (0) 2020.06.06 화학 1 “2013년 1학기 기말 시험” (1) 2020.05.31 화학 1 “2012년 1학기 기말 시험” (0) 2020.05.28 화학 1 “2017년 1학기 기말 시험” (1) 2020.05.26 화학 1 “2016년 1학기 기말 시험” (0) 2020.05.26