일반 화학 “2017년 2학기 중간 시험”
“일반화학 2017학년도 2학기 중간 시험”
1. 열역학에 관련된 다음 설명 중 옳은 것을 모두 고른 것은?
① ㄱ, ㄴ
② ㄴ, ㄷ
③ ㄴ, ㄷ, ㄹ
④ ㄷ, ㄹ
⑤ ㄴ, ㄹ
ㄱ. 엔탈피는 상태 성질이면서 크기 성질이다.
ㄴ. 계의 엔탈피가 감소하면 주위는 열을 얻는다.
ㄷ. 외부 압력 > 0 인 상태에서 기체 계가 팽창하면 w>0이다.
ㄹ. 일어나지 않는 반응의 반응 엔탈피는 구할 수 없다.
답 : 1
2. 아래 그림은 같은 온도에서 두 불활성 기체의 속력분포이다. 이에 대한 설명 중 옳지 않은 것은? 단, 모두 이상기체로 가정.

① 같은 온도에서 기체 1분자가 용기의 벽에 한번 충돌할 때 가하는 평균 힘은 기체 2보다 크다
② 같은 온도에서 기체 2의 평균 운동에너지는 기체 1보다 크다
③ 같은 온도에서 기체 1의 확산 속도가 기체 2보다 느리다.
④ 기체 1의 평균속력이 기체 2보다 작다.
⑤ 기체 1의 분자량은 기체 2보다 크다.
답 : 2
3. 다음 반응식 중 균형이 맞은 것은?
①

②

③

④

⑤
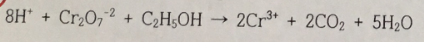
4. 화합물 NO, N2H4, N2O, NH3에 들어 있는 모든 원자의 산화수 중 가장 큰 값은?
① +3
② -2
③ -1
④ +1
⑤ +2
답 : 5
5. 화학반응에 대한 다음 설명 중 옳지 않은 것은?
① 전자를 잃는 원자를 포함한 화학종이 산화제이다.
② 화학종 간에 전자를 주고받는 반응은 산화-환원반응이다.
③ 침전 반응의 전체 반응식에는 구경꾼 이온들이 존재한다.
④ 단원자 이온의 산화수는 그 이온의 전하와 같다.
⑤ 두 이온화합물 수용액을 섞을 때 침전이 생성될지 예측할 수 있다.
6. 다음 설명 중 옳지 않은 것은?
① 고체 NaCl에는 전류가 흐르지 않는다.
② 순수한 물에는 전류가 거의 흐르지 않는다.
③ 물에 용해된 이온 화합물은 모두 이온화한다.
④ 수용액 중의 양이온과 음이온들은 모두 수화되어 있다.
⑤ 수용액에 전류를 흘리면 전자들이 이동하면서 전류가 흐른다.
답 : 5
<단답형 문항 : 각 5점 > : 단답형 문제는 풀이 과정이없어 최종 답만을 답안지의 해당 란에 쓰세요.
1. KHP(KHC8H4O4) 0.4016g을 녹여 수용액 20.0mL를만들었다. 이 용액을 적정하는 데 NaOH 용액 15.00mL가 소모되었다. NaOH 수용액의 몰 농도를 구하라. 단, KHP와 NaOH는 1:1로 반응한다.
답 : 0.131M
2. 마그네슘(Mg)와 질소가 반응하여 생성되는 이온 화합물의 화학식을 써라.
답 : Mg3N2
3. 0.150M 과망간산칼륨(KMnO4) 용액 200.0mL를 만들려고 한다. 200mL 용량 플라스크에 넣어야 할 KMnO4의 질량은 얼마인가?
답 : 4.74g
4. 1000℃의 엔진 내부에 들어있는 H2 분자와 25℃의 N2의 제곱 평균근 속도의 비를 구하라. 반드시 큰 값/ 작은값의 비를 답란에 써라.
답 : 7.7
5. 27℃, 2.00L 용기에 CO2 215g이 들어있다. 이상기체법칙과 van der Waals 식으로 구한 압력의 차이를 atm 단위로 써라. 단, CO2 기체의 a=3.59(atm*L^2)/mol^2, b=0.0427L/mol이다.
답 : 14.5atm
6. 293℃, 1기압에서 다음과 같이 CaC2 3mol이 완전히 반응하는 과정의 일 w를 kJ 단위로 구하여 답란에 쓰시오. 단, 고체와 액체의 부피는 무시한다.

답 : -14.24kJ
<주관식 문항: 각 10점>
주의 : 주관식 문제는 풀이 과정이 없으면 부정행위로 간주하여 0점 처리합니다. 답안지 칸이 부족하면 답안지 뒷면을 이용하세요.
1. 다음 자료를 이용하여 기체 HCl의
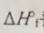
를 구하라.

답 : -92.3kJ
2. B5H9과 산소는 다음과 같이 반응한다.

B5H9과 126.0g을 산소 480.0g과 반응시켰다. 생선된 B2O3의 질량을 g 단위로 구하라. 단, 반응 수득률은 100%라고 가정한다.
답 : 348.1g
3. SiH4는 다음 두 단계 반응으로 만든다.
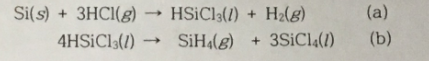
a. 10.00atm, 35℃에서 HCl 15.00L를 써서 HSiCl3 200.0g을 얻었다면 HSiCl3의 퍼센트 수율은 얼마인가?(5점)
b. HSiCl3 200.0g을 사용하여 반응 (b)를 통하여 SiH4를 얻었다. 퍼센트 수율이 83.0%라면 10.00atm, 35℃에서 생성된 SiH4의 부피는 얼마인가? L 단위로 구하라. (5점)
답.
a. 74.67%
b. 0.773L
4. C, H, N만을 포함하는 화합물에서 질량비로 C는 58.51%, H는 7.37%이다. 또, 200℃, 190.0 torr에서 이 화합물 기체의 밀도는 0.2637g/L이다.
a. 이 화합물의 실험식을 구하라 (5점)
b. 이 화합물의 분자식을 구하라. (5점)
답.
a. C2H3N
b. C2H3N