일반 화학 “2017년 2학기 기말 시험”
일반 화학 “2017년 2학기 기말 시험”

<5지 선다형 : 각 문항 5점>
1. 용액과 총괄성에 대한 다음 설명 중 옳지 않은 것은?
① 삼투압은 용매 분자의 무작위한 움직임 때문에 나타난다.
② 설탕물이 얼기 시작하면 용액 중의 설탕의 농도는 증가한다.
③ 비커의 소금물 용액이 얼기 시작하면 어는점은 점점 낮아진다.
④ 비휘발성 용질이 녹은 용액의 끓는점은 항상 순수한 용매보다 높다.
⑤ 용매와 용액 간의 삼투현상을 멈추게 하려면 용매에 삼투압 만큼의 압력을 외부에서 가해 주어야 한다.
답 : 5
2. 화학 결합에 대한 다음 설명 중 옳은 것은?
① 결합 길이는 두 원자(또는 이온) 간의 퍼텐셜 에너지가 0인 거리이다.
② C=C의 결합 에너지는 C-C 결합에너지의 2배이다.
③ 이온결합은 모두 부분 공유결합성을 갖는다.
④ 무극성 분자에 있는 모든 결합은 극성이 없다.
⑤ 원자 반지름이 클수록 공유결합의 세기는 강하다.
답 : 3
3. 다음 설명 중 옳은 것은?
① 3p 궤도함수는 마디가 2개이다.
② n=3인 껍질 속에는 d 궤도함수가 없다.
③ 수소 원자에서 궤도함수의 에너지는 l값이 결정한다.
④ 원자의 에너지 준위가 양자화되어 있음을 보여주는 실험적 증거는 흑체복사 현상이다.
⑤ 2p 궤도함수에 전자가 2개 채워지면 항상 2px와 2py 궤도함수에 각각 하나씩 나란한 스핀을 가지고 들어간다.
답 : 1
4. 오른편 위의 그림은 황의 상평형 그림이다. 이 그림에 근거하여 추론한 것으로 옳지 않은 것은?

① 고체 황은 승화한다.
② 1기압, 96℃에서는 사방황이 가장 안정하다.
③ 100 기압 하에서 사방황은 녹지 않는다.
④ 압력을 높이면 고체 황의 녹는점이 낮아진다.
⑤ 130℃에서 고체 단사황에 가해지는 압력을 낮추면 액체로 된다.
답 : 4
5. 다음 설명 중 옳은 것은?
① 흑연에는 π-결합만 존재한다.
② 물 분자 간에는 분산력도 작용한다.
③ 육방 최조밀 쌓임 구조의 배위수는 14이다.
④ 다이아몬드에는 이동할 수 있는 전자가 있다.
⑤ 반도체에서는 채워진 MO와 빈 MO가 서로 닿아 있다.
답 : 2
<단답형 문항 : 각 5점> : 단답형 문제는 풀이 과정이 없이 최종 답만을 답안지의 해당 란에 쓰세요.
1. 어떤 액체의 증기압을 여러 온도에서 측정하여 1/T에 대해 ln(P)의 그래프를 그렸더니 직선의 기울기가 -2406K이었다. 이 물질의 발열을 kJ/mol 단위로 구하라.
답 : 20kJ/mol

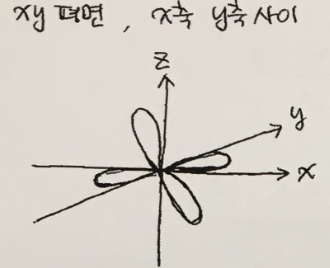
2. 답안지에 dxy의 모양을 가능한 한 정확히 그리시오.
답 :


3. 파장이 1.54Å인 X-선을 사용하여 알루미늄 결정을 분석하였더니 θ=19.3도에서 강한 회절 무늬가 관찰되었다. 이 회절 무늬를 만든 원자들의 층과 층 사이의 거리 d를 pm 단위로 구하라. 단, n=1이다.
답 : 233pm

4. 은(Ag)의 바닥상태 전자배치를 써라.
답 : [Kr]4d10 5s1


5. 어떤 진한 질산 용액의 몰농도는 12.00M이다. 이 용액에서 HNO3의 질량백분율을 구하라. 단, 이 진한 질산 용액의 밀도는 1.20g/mL임.
답 : 63%

6. 어떤 들뜬 상태에 있는 수소 원자가 있따. 이 원자로부터 전자를 떼어 내어 이온화시키는 데 필요한 빛의 최대 파장이 1460nm이었다. 이 들뜬 수소 원자에 들어 있는 전자가 바닥상태로 전이할 때 방출되는 빛의 파장을 nm 단위로 구하라.
답 : 97.3nm
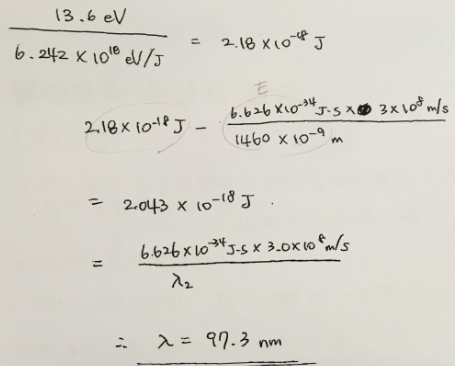
7. 다음 이온들 중에서 등전자 이온들을 찾아 그 크기가 증가하는 순서로 나열하시오.
Ca^2+ , O^2- , K^+ , Cl^-
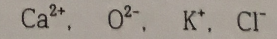
답 : Ca^2+, K^+, Cl^-

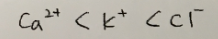
<주관식 문항 : 각 10점>
주의 : 주관식 문제는 풀이 과정이 없으면 부정행위로 간주하여 0점 처리합니다. 답안지 칸이 부족하면 답안지 뒷면을 이용하세요.
1. (10점) 다음 자료로부터 NaF의 격자 에너지를 kJ/mol 단위로 구하라.
NaF의 표준 생성 엔탈피 △Hfº = -570kJ/mol
F의 전자 친화도 = -328kJ/mol
Na의 승화 엔탈피 = 161kJ/mol
F2의 결합 에너지 = 154kJ/mol
Na의 이온화 에너지 = 495kJ/mol
답 : -570+328-161-77-495=-975kJ/mol
NaF의 표준 생성엔탈피 - F의 전자친화도 - Na 승화엔탈피 - F2의 결합에너지 / 2 - Na의 이온화 에너지
= NaF의 격자 에너지
-570+328-161-77-495=-975kJ/mol
(단위, 부호 -2, 나머지 과정 부분점수 X)
2.(10점) 어떤 금속 원소의 결정은 한 변이 392pm인 면심입방 단위세포의 배열을 가지며 밀도는 21.45g/cm^3이다. 이 금속의 원자량을 g/mol 단위로 구하고 원소 기호를 쓰시오. (실험 오차를 고려하여 최선의 답을 구하라.)
답 : 194.145g/mol, 백금(Pt)

3.(10점) 어떤 포도당(몰질량 180.0g/mol) 수용액의 어는점은 -2.79℃이다. (이상용액으로 가정.)
(a) 이 수용액의 몰랄농도를 구하라.(2점)
답 : 1.5mol/kg
△Tf = Kf x m
m = △Tf / Kf = 1.5mol/kg

(b) 25℃에서 이 용액의 삼투압을 구하라. (5점) 단, 이 수용액의 밀도는 순수한 물과 같다고 가정한다.
답 : 28.88atm
π=MRT, d=1g/ml
m=1.5인 용액의 M=1.5mol/1.27L - 2점
π=1.5mol/1.27L x 0.08206Latm/molK x 298K
=28.88atm - 3점
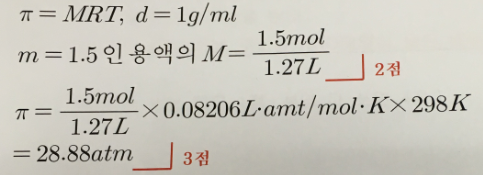
(c) 포도당의 질량백분율을 구하라.(3점)
답 : 21.26%
m=1.5mol/kg
wt% = 0.27kg/1.27kg x 100 = 21.26% - 3점
4. (10점) 실험적 연구에 의하면 N2O 분자는 선형이며 극성분자이다.
a. 문제에 주어진 실험적 자료를 이용하여 NNO와 NON 배열 중 어느 것이 옳은 배열인지 판단하라.(4점)
답 : NNO 배열
N≡N과 N-O의 반데르발스힘의 차이가 있기 때문에 극성을 띈다. 하지만 NON배열에서 N=O의 반데르발스 힘 차이가 없기 때문에 무극성을 띈다.
따라서, 선형, 극성 구조인 NNO 배열이 옳은 배열이다.
(이것만 쓰면 1점, 설명 다 쓰면 4점)
b. a의 답을 근거로 N2O의 Lewis 구조(공명구조 포함)를 그리고 각 원자의 형식 전하를 표시하라.(6점)
답 :
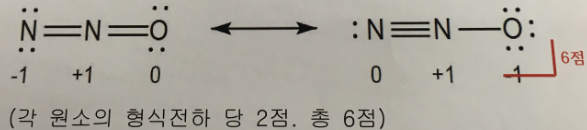
* 주의 : 이 문제는 단계적으로 푸는 문제이므로 a의 답이 틀리면 뒷 문제는 자동으로 0점으로 채점합니다.
