화학 1 “2012년 1학기 기말 시험”
화학 1 “2012년 1학기 기말 시험”

<5지 선다형 : 각 문항 5점>
1. 다음 설명 중 옳지 않은 것은?
① 다전자 원자에서 같은 껍질에 속하는 부껍질의 에너지가 서로 다른 것은 차폐와 침투 능력의 차이 때문이다.
② He+ 이온에서 2s 궤도함수(AO)는 2p AO보다 에너지가 낮다.
③ 주양자수가 n인 껍질에 채워질 수 있는 최대 전자수는 2n^2이다.
④ 2p 궤도함수에 전자가 2개 채워지면 마디면으로 분리된 궤도함수의 두 영역에 하나씩 전자가 들어간다.
⑤ 바닥상태의 Be 원자는 상자기성을 갖지 않는다.
답 : 4
2. 다음 그림은 어떤 2원자 분자의 핵간 거리에 대한 퍼텐셜에너지를 나타낸 것이다. 이 그림에 대한 설명 중 옳은 것은?
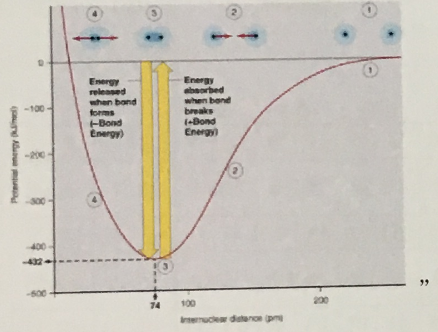
① 점 1의 이 분자는 거의 해리된 상태이다.
② 점 3에서는 두 원자 간에 인력만 작용한다.
③ 점 4에 있는 분자는 점 2에 있는 분자보다 더 많은 에너지를 가지고 있다.
④ 두 원자가 무한히 멀리 있을 때 가장 안저하다.
⑤ 이 분자에 300kJ/mol의 에너지를 가하면 원자로 분해된다.
답 : 1
3. 이온화에너지(kJ/mol)가 다음과 같은 2주기 원소는?
IE1 = 800
IE2 = 2430
IE3 = 3660
IE4 = 25020
① Li
② Be
③ B
④ C
⑤ N
답 : 3
4. 다음 설명 중 옳지 않은 것은?
① O2의 결합에너지는 O2^+보다 작다.
② In 화합물에는 In2+과 In4+ 이온이 존재한다.
③ Li의 2차 이온화에너지는 Be의 3차 이온화에너지보다 작다.
④ N^3- 이온의 반지름은 O^2-의 이온 반지름보다 크다.
⑤ MgO의 격자에너지는 CaO보다 크다.
답 : 2
5. 다음 원소의 바닥상태 전자배치가 옳지 않은 것은?
①
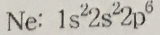
②

③
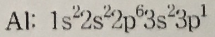
④
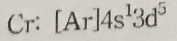
⑤

답 : 5
6. 가장 타당한 루이스 구조를 근거로 하여, 세 이온 N3^-, CO2, I3^-에 대한 설명 중 옳은 것만을 <보기>에서 있는 대로 고른 것은?
<보기>
ㄱ. 중심 원자의 비공유 전자쌍의 수는 I3^- > CO2 > N3^-
ㄴ. 중심 원자의 산화수 값은 CO2>N3^->I3^-이다.
ㄷ. 세 이온은 모두 선형 구조를 갖는다.
① ㄱ
② ㄴ
③ ㄱ,ㄴ
④ ㄴ, ㄷ
⑤ ㄱ, ㄴ, ㄷ
답 : 4
7. 다음 분자 중 극성을 갖는 분자는?
① IF5
② CH4
③ XeF4
④ BF3
⑤ PCl5
답 : 1
8. 다음 중 중심원자의 궤도 혼성이 옳지 않게 짝지어진 것은?
① NH3 - sp3
② BrF3 - sp3d2
③ SF4 - sp3d
④ XeF4 - sp3d2
⑤ BF3 - sp2
답 : 2
9. 다음 중 결합에너지가 가장 작은 것은?
① F2^2+
② F2^+
③ F2
④ F2^-
⑤ F2^2-
답 : 5
10. 다음 설명 중 옳지 않은 것은?
① H2C=O 분자에서 O 원자는 sp2 혼성궤도함수를 갖는다.
② 공명 혼성은 결합 전자를 더 넓은 영역에 퍼지게 하여 분자나 이온을 안정화한다.
③ NCO- 이온의 공명구조 중 산화수의 합이 가장 작은 것이 가장 안정한 구조이다.
④ 이온결합 형성의 가장 큰 구동력은 격자 형성과정이다.
⑤ C2H2 분자에서 C 원자간 결합은 σ 결합 1개와 π 결합 2개이다.
답 : 3
11. 다음 자료를 이용하여 (1/2)*CH4(g) + O2(g) → (1/2)CO2(g) + H2O(g) 반응의 반응엔탈피를 kJ 단위로 구하면?

① -302
② -355
③ -710
④ -906
⑤ -1208
답 : 2
12. 시안산 이온의 Lewis 구조 중 가장 안정한 것은 어느 것인가? (고립전자쌍과 전하 표기는 생략하였음.)
① O = C = N
② N - C ≡ O
③ O - C ≡ N
④ O ≡ N - C
⑤ O = N = C
답 : 3
<화학 1 주관식 문항>
주의 : 주관식 문제1, 2, 3번의 경우 답을 구하는 과정이나 답에 대한 근거가 없으면 부정행위로 간주하여 0점 처리합니다. 답안지 칸이 부족하면 답안지 뒷면을 이용하세요.
1.(13점) H 원자의 n = 4인 준위에서 n = 2인 준위로의 전이에서 486nm의 가시광선이 방출되었다.
a. Rydberg상수를 m^-1 단위로 구하라. (7점)
b. H 원자 1개의 이온화에너지를 J 단위로 구하라. (6점)
*주의 : 이 문제는 단계적으로 푸는 문제이므로 a를 풀지 않고 b를 푼 경우는 0점으로 채점합니다.
답 :
a.

b.

2. I3^- 이온에 대하여 다음에 답하시오. (15점, 각 3점)
a. 원자가 전자의 총수를 구하라.
b. Lewis 구조를 그려라.
c. 해당 구조의 VSEPR 일반식을 써라.
d. 중심원자의 혼성궤도를 말하라.
e. 분자의 모양을 가능한 정확히 그려라.
*주의 : 이 문제는 단계적으로 푸는 문제이므로 a나 b의 답이 틀리면 뒷 문제의 답이 정답이라도 0점으로 채점합니다.
답 :
a. 11x2 = 22개
b.

c. AX2E3

d.

각 3점.
단, 1, 2번 중 하나라도 정답이 아닌 경우 3, 4, 5번은 모두 오답처리.
3. B2 이온의 MO 그림을 그리고, 전자배치를 표시한 후 결합차수를 구하고, 상자기성을 예측하라. (12점)
답 :